Les enzymes présentent une double spécificité: spécificité d'action, et de substrat. Les propriétés des enzymes dépendent de leur structure spatiale. la structure tridimentionnelledes protéines peut être affectée par des changements de la séquence des acides aminés ( mutations) mais aussi par des facteurs de l'environnement comme le pH, la température, la présence d'ions.
Quelle est l'influence de ces paramètres sur l'activité des enzymes?
On étudie l'action de la température sur une enzyme salivaire: l'amylase qui hydrolyse l'amidon.
Quels sont les produits que l'on obtient lorsque l'amidon est hydrolysé?
Ecrire la ou les réactions.
Une vue en 3D de l'amylase salivaire. ( si vous ne la voyez pas, installez le plugin chime.)
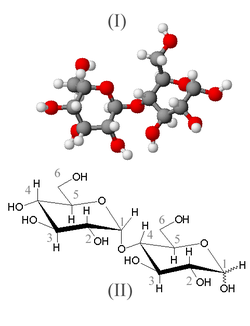
L'hydrolyse enzymatique de l'amidon par l'amylase salivaire ne libère que du maltose.(c'est l'hydrolyse chimique en milieu acide de l'amidon libère du glucose) Le maltose est un diholoside ( sucre à 12 carbones comme le saccharose; le saccharose et le maltose sont des isomères) formé par 2 molécules de glucose.
Équation de la réaction d'hydrolyse. :
(C6H10O5)n + n/2 H2O → n/2 C12H22 O11!
amidon + eau → maltose
C'est une autre enzyme: la maltase qui transforme le maltose en deux molécules de glucose.
- Vers 35°C,40°C l'activité de l'amylase est maximale ( vitesse maximale), cette température est appelée température optimale.
- A 0°C, l'activité de l'enzyme est nulle, on parle d'inactivation ( on peut aussi utiliser le terme de dénaturation). Si l'on replace l'enzyme à une température convenable, elle est à nouveau active. L'inactivation des enzymes est donc réversible.
- A 60°C, l'activité de l'amylase est nulle ( rappel: les températures élevées font coaguler les protéines : cuisson du blanc d'oeuf), on parle de dénaturation des enzymes. La dénaturation est un phénomène irréversible.
| température en °C |
- 5 | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Temps en minutes |
/ |
100 |
56 |
42 |
29 |
20 |
16 |
13 |
10 |
9.6 |
12 |
19 |
91 |
/ |
la courbe de la vitesse de la réaction en fonction de la t°. (rappel V = Q : tps).
Commentez la courbe obtenue.
Vitesse maximale pour une température optimale de 35°-40°.
60° dénaturation irréversible de l'enzyme (rappel : les températures élevées font coaguler les protéines).
0° inactivation ( on peut utiliser le terme de dénaturation) réversible de l'amylase salivaire.
pH |
1 |
1,2 |
1,4 |
1,6 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
8,5 |
9 |
10 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
trypsine |
0 |
0 |
0 |
0 |
0,5 |
2 |
9 |
11,7 |
12 |
11 |
5 |
3 |
1 |
0 |
maltase |
0 |
0 |
0 |
0 |
0 |
0 |
0,2 |
1 |
2,2 |
4,5 |
8 |
11 |
7 |
1,1 |
pepsine + S1 |
0 |
9 |
7 |
2,5 |
1,5 |
0,9 |
0,7 |
0,3 |
0,2 |
0 |
0 |
0 |
0 |
0 |
pepsine + S2 |
0 |
0,2 |
1,1 |
2,5 |
4 |
6,6 |
9,2 |
8,2 |
3,5 |
1 |
0 |
0 |
0 |
0 |
pepsine + S3 |
0 |
3,7 |
6,2 |
9 |
7 |
1,6 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
Commentez les courbes obtenues.
Pour chaque enzyme, il existe un pH optimum qui correspond à une activité de l'enzyme maximale. Certaines enzymes gardent une activité élevée même si l'on s'éloigne de ce pH optimum; ce sont des enzymes "indifférentes" au pH; d'autres enzymes ont besoin d'un pH très précis pour avoir une activité élevée. Le pH optimum d'une enzyme peut varier selon le substrat.
Chercher dans quelle partie de l'appareil digestif de l'homme se trouvent ces enzymes et quel est le pH de ces différentes parties.
http://www.ac-reunion.fr/pedagogie1/circons/port1/site_web/fonctionnutrition/secretion.htm
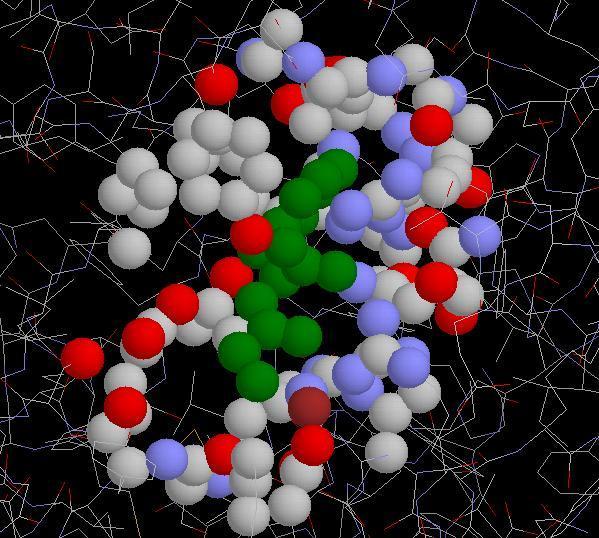
Vue en 3D de la carboxypeptidase
Quelle est la forme de cette enzyme ? |
Cette enzyme a une forme de pelote ( forme globulaire) |
Combien de groupements (AA) ? |
Il y a 307 AA dans cette enzyme. |
1. La structure primaire de la protéine |
|
Quelle est la disposition des acides aminés ? |
succession linéaire d’acides aminés reliés entre eux par des liaisons peptidiques. |
Quel est le nom du premier acide aminé ? |
Il porte le NH2 terminal, c’est l’Alanine. |
Quel est le nom du dernier acide aminé ? |
Il porte le COOH terminal, c’est l’Asparagine. |
Quelle est la séquence des 5 premiers acides aminés ? |
ALA-ARG-SER-THR-ASN |
Quels sont les atomes qu'on retrouve dans tous les acides aminés |
C,H,O,et N |
Quels sont les atomes qui ne sont présents que sur certains acides aminés ? |
S comme par exemple la CYS |
2. La structure secondaire de la protéine |
|
Combien d'acides aminés dans cette chaîne ? |
|
Combien de tours d'hélice ? |
|
Combien d'acides aminés par tour d'hélice ? |
Il ya 3 ou 4 AA par tour d’hélice. |
Combien d'acides aminés dans cette chaîne en feuillet ? |
|
Combien de fragments de chaînes composent ce feuillet ? |
Il y a 12 fragments de chaînes |
Comment ces fragments sont-ils disposés dans le feuillet ? |
Les différents fragments en feuillet sont parallèles |
Est-ce une structure en feuillet " pure " ?; |
Non il y a des coudes. |
A quoi correspond la couleur rouge ? Combien y en a-t-il ? |
Ce sont les parties en hélice, il y en a 11 dans la molécule. |
A quoi correspond la couleur jaune ? Combien y en a-t-il ? |
Ce sont les parties en feuillets, il y en a 12 dans cette enzyme. |
A quoi correspondent les autres couleurs ? |
Les autres parties sont celles qui ne sont ni en hélice ni en feuillet, elles forment souvent des coudes. |
3. La structure tertiaire de la protéine |
|
Combien y a-t-il d'atomes de soufre |
Il y a 5 atomes de Soufre. |
Participent-ils tous à des ponts disulfures? |
Il n’y en a que 2 qui participent à un pont disulfure. |
Quels autres facteurs de réalisation d'une structure tertiaire connaissez-vous? |
Les liaisons hydrogène (comme dans la molécule d’ADN) |
Faire tourner la molécule : Que remarquez-vous ? Nature de cet élément ? |
Il y a un atome de ZINC tout seul au milieu de la molécule. |
Ecrire la formule chimique développée du substrat (compléter avec les hydrogènes non représentés). Quelle est la nature de ce substrat ? |
Sa formule chimique est |
La spécificité de fonction de la carboxypeptidase est l'hydrolyse. Quel substrat de cette enzyme n'est pas représenté? |
Pour l’hydrolyse, une molécule d’H2O est nécessaire |
Réfléchir au nom de cette enzyme ; que signifie-t-il ? |
Cette enzyme attaque le substrat en décrochant l’acide aminé porteur du COOH terminal : TYR |
4. Le complexe enzyme-substrat |
|
Quels sont les AA (et leur position) à proximité du substrat ? |
HIS69, GLU72 et HIS196, ARG145, TYR248 et GLU270 |
Quelle remarque pouvez-vous faire quant à leur position dans la séquence de la protéine enzymatique ? N'y a-t-il que des AA ? |
Les acides aminés sont souvent éloignés dans la séquence de la protéine enzymatique mais rapprochés dans la structure spatiale. |
Trois AA appartiennent au site catalytique proprement dit : HIS69, GLU72 et HIS196 |
|
Le substrat en vert et les acides aminés du site actif, remarquez l'atome de zinc! |
|